Mau Tahu Asam dan Basa ? hmmmmm?????
Belajar tentang asam dan basa, asam dalam pelajaran kimia adalah senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7.
Dalam definisi modern, asam adalah suatu zat yang dapat memberi proton (ion H+) kepada zat lain (yang disebut basa), atau dapat menerima pasangan elektron bebas dari suatu basa.
Jenis asam menurut keorganikannya, dapat dibedakan menjadi dua macam yaitu asam organik dan asam anorganik.
Istilah "asam" merupakan terjemahan dari istilah yang digunakan untuk hal yang sama dalam bahasa-bahasa Eropa seperti acid (bahasa Inggris), zuur (bahasa Belanda), atauSäure (bahasa Jerman) yang secara harfiah berhubungan dengan rasa masam. Dalam kimia, istilah asam memiliki arti yang lebih khusus. Terdapat tiga definisi asam yang umum diterima dalam kimia, yaitu definisi Arrhenius, Brønsted-Lowry, dan Lewis.
- Arrhenius: Menurut definisi ini, asam adalah suatu zat yang meningkatkan konsentrasi ion hidronium (H3O+) ketika dilarutkan dalam air. Definisi yang pertama kali dikemukakan oleh Svante Arrhenius ini membatasi asam dan basa untuk zat-zat yang dapat larut dalam air.
- Brønsted-Lowry: Menurut definisi ini, asam adalah pemberi proton kepada basa. Asam dan basa bersangkutan disebut sebagai pasangan asam-basa konjugat. Brønsteddan Lowry secara terpisah mengemukakan definisi ini, yang mencakup zat-zat yang tak larut dalam air (tidak seperti pada definisi Arrhenius).
- Lewis: Menurut definisi ini, asam adalah penerima pasangan elektron dari basa. Definisi yang dikemukakan oleh Gilbert N. Lewis ini dapat mencakup asam yang tak mengandung hidrogen atau proton yang dapat dipindahkan, seperti besi(III) klorida. Definisi Lewis dapat pula dijelaskan dengan teori orbital molekul. Secara umum, suatu asam dapat menerima pasangan elektron pada orbital kosongnya yang paling rendah (LUMO) dari orbital terisi yang tertinggi (HOMO) dari suatu basa. Jadi, HOMO dari basa dan LUMO dari asam bergabung membentuk orbital molekul ikatan.
Walaupun bukan merupakan teori yang paling luas cakupannya, definisi Brønsted-Lowry merupakan definisi yang paling umum digunakan. Dalam definisi ini, keasaman suatu senyawa ditentukan oleh kestabilan ion hidronium dan basa konjugat terlarutnya ketika senyawa tersebut telah memberi proton ke dalam larutan tempat asam itu berada. Stabilitas basa konjugat yang lebih tinggi menunjukkan keasaman senyawa bersangkutan yang lebih tinggi.
Sistem asam/basa berbeda dengan reaksi redoks; tak ada perubahan bilangan oksidasi dalam reaksi asam-basa.
Asam organik
Asam organik adalah asam karboksilat atau asam yang terbentuk karena persenyawaan dengan senyawa organik (misalnyahidrokarbon).
Contoh asam organik:
- Asam asetat (CH3COOH)
- Asam benzoat (C6H5COOH)
- Asam format (HCOOH)
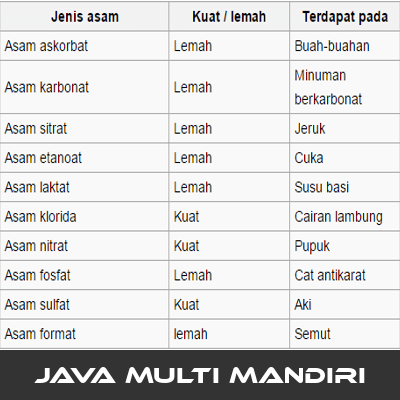
- Asam askorbat
- Asam karbonat
- Asam sitrat
- Asam etanoat
- Asam laktat
- Asam fosfat
Semua asam organik adalah asam lemah.
Asam anorganik
Asam anorganik adalah asam yang terbentuk karena persenyawaan dengan senyawa anorganik (misalnya hidrogen dengan klorin). Asam anorganik ada yang merupakan asam kuat, yaitu:
- Asam sulfat (H2SO4)
- Asam klorida (HCl)
- Asam nitrat (HNO3)
- Asam bromida (HBr)
- Asam iodida (HI)
- Asam klorat (HClO4)
Contoh bahan yang mengandung asam:
Asam memiliki sifat-sifat yaitu bereaksi dengan logam serta dapat menghantarkan arus listrik (untuk asam kuat). Selain itu asam juga dapat mengubah warna kertas lakmus biru menjadi warna merah dan mempunyai rasa asam dan bersifat korosif.
Asam juga dapat ditimbulkan akibat adanya hujan asam yang dapat menyebabkan matinya hewan dan tumbuhan. Selain itu hujan asam juga dapat merusak bangunan yang terbuat dari batu kapur dan dapat merusak jembatan, bodi mobil, kapal laut dan struktur bangunan lainnya.
Mau Tahu Asam dan Basa ? hmmmmm?????
Basa adalah senyawa kimia yang menyerap ion hidronium ketika dilarutkan dalam air. Basa memiliki pH lebih besar dari 7. Menurut Arrhenius basa adalah zat yang jika dilarutkan dalam air akan melepaskan ion hidroksida (OH-) sedangkan Menurut Bronsted-Lowry basa adalah akseptor proton (H+).
Sifat - sifat Basa :
- Kaustik
- Rasanya pahit
- Licin seperti sabun
- Nilai pH lebih dari 7
- Mengubah warna lakmus merah menjadi biru
- Dapat menghantarkan arus listrik
- Menetralkan asam
- Menyebabkan pelapuka
Contoh basa kuat:
- Litium hidroksida (LiOH)
- Natrium hidroksida (NaOH)
- Kalium hidroksida (KOH)
- Kalsium hidroksida (Ca(OH)2)
- Stronsium hidroksida (Sr(OH)2)
- Rubidium hidroksida (RbOH)
- Barium hidroksida (Ba(OH)2)
- Magnesium hidroksida (Mg(OH)2)
Semua basa lainnya selain 8 macam basa ini merupakan basa lemah.
Alat untuk mengukur skala keasaman atau pH adalah pH meter dan kertas lakmus. Skala pHnya adalah antara 0-14. Jika memakai kertas lakmus, maka zat yang bersifat asam mengubah lakmus biru menjadi merah dan zat yang bersifat basa mengubah lakmus merah menjadi biru. Namun untuk jaman yang sudah modern ini Anda tidak perlu repot-repot dalam menentukan tingkat keasaman atau kebasaan pada cairan, cukup dengan menggunakan alat ukur pH yang banyak di jual di pasaran. Salah satunya adalah di CV. Java Multi Mandiri sebagai penyedia berbagai macam solusi alat pengukuran untuk Anda.
Tingkat keasaman
- 0 – 6,9 = asam
- 7 = netral
- 7,1 – 14 = basa















This is a nofollow link
ReplyDelete